Nowe dane o rozmieszeniu, biologii i behawiorze gatunków z rodziny kózkowatych (Coleoptera, Cerambycidae) z Grecji
1) Instytut Badawczy Leśnictwa, Zakład Ochrony Lasu, ul. Braci Leśnej 3, Sękocin Stary, 05-090 Raszyn, e-mail: r.plewa@ibles.waw.pl
2) Al. Chopina 102a, 05-092 Łomianki Dolne, e-mail: agrias@interia.pl
3) Wydział Medycyny Weterynaryjnej, SGGW, Katedra Nauk Przedklinicznych, Zakład Parazytologii i Inwazjologii, ul. Ciszewskiego 8, 02-786 Warszawa, e-mail: pawel.kryzys@op.pl
Streszczenie. Na podstawie trzyletnich badań w latach 2007-2009 stwierdzono 106 gatunków kózkowatych (ponad 32% fauny Cerambycidae Grecji), w tym dwa nowe gatunki dla fauny Grecji: Phytoecia (Opsilia) molybdaena (Dalman, 1817) i Aegomorphus clavipes (Schrank, 1781). Badania prowadzono zarówno w części północnej (kontynentalnej), jak i południowej Grecji (Peloponez). Przeprowadzone obserwacje terenowe i późniejsze hodowle laboratoryjne pozwoliły na uzyskanie nowych informacji na temat biologii, roślin żywicielskich i zachowania poszczególnych gatunków kózkowatych.
Abstract. Studies on the longhorn beetles of Greece were carried out in 2007-2009 in northern (continental), as well as in the southern (the Peloponnesus) part of the country. As a result, 106 species were found, which is more than 32% of the whole cerambycid fauna of this country. Two species, i.e. Phytoecia (Opsilia) molybdaena (Dalman, 1817) and Aegomorphus clavipes (Schrank, 1781), are new for the fauna of Greece. New data on the biology, host plants and behavior of particular species were obtained by field observations and subsequent laboratory rearing.
Key words: Distribution, biology, behavior, Coleoptera, Cerambycidae, Europe, Greece
WSTĘP
Grecja od wielu lat należy do bardzo ciekawych, pod względem entomologicznym miejsc w Europie. Jej górzysty teren jest bardzo zróżnicowany pod względem klimatycznym, jak i występującej tam bogatej flory. Specyficzne ukształtowanie terenu i zarazem jego niedostępność sprawia, że Grecja nadal należy do słabo zbadanych. Nawet tak popularna rodzina, jak Cerambycidae, preferowana przez wielu entomologów nie należy do wystarczająco dobrze poznanych.
Obecny stan kózkowatych Cerambycidae w Grecji (z wyłączeniem Krety) wynosi 330 gatunków (w tym 105 podgatunków), z czego 93 to endemity (Danilevsky 2011). W samym ostatnim dziesięcioleciu opisano 17 nowych dla wiedzy taksonów szczebla gatunkowego. Są to głównie gatunki z rodzaju Dorcadion Dalman, 1817, które występują bardzo lokalnie w górach na różnych wysokościach.
Celem niniejszej pracy jest uzupełnienie dotychczasowych informacji o rozmieszczeniu, biologii i zachowaniu chrząszczy z rodziny kózkowatych. Praca ma również dostarczyć cennych uwag, dotyczących rozwoju osobniczego wybranych gatunków, stwierdzonych podczas hodowli laboratoryjnych.
METODYKA
Badania nad fauną kózkowatych prowadzono w latach 2007-2009, w tych samych okresach od 14 do 29 maja. Obejmowały one kontynentalną Grecję (północna i północno-wschodnia część), a także południową część kraju (Półwysep Peloponeski). Jedynie w 2007 roku kózkowate pozyskiwano tylko na terenie części kontynentalnej. Owady zbierano stosując kilka metod w zależności od behawioru gatunku i ich powiązań troficznych z roślinami żywicielskimi. Stosowanymi metodami połowu było:
- wypatrywanie na roślinach żywicielskich i ich częściach, tj.: kwiaty, liście, pędy, korowina lub wypatrywanie na glebie (L),
- kilkukrotne uderzenia czerpaka entomologicznego po roślinności zielnej, krzewiastej i niskiej roślinności drzewiastej (S),
- otrząsanie na parasol entomologiczny owadów z niskich drzew i krzewów (U),
- przeglądanie pni przy użyciu światła sztucznego (A),
- hodowle laboratoryjne stadiów przedimaginalnych (B).
Do objaśnienia tabeli z wynikami zastosowano następujące podziały:
- wg wysokości stwierdzenia n.p.m.:
- nizinny: < 400m n.p.m.(N),
- wyżynny: 400m – 800m n.p.m.(W),
- górski: 800m – 1200m n.p.m. (G),
- wysokogórski: >1200m n.p.m. (WG)
- wg sposobu stwierdzenia (symbole: L, S, U, A i B opisano w części metodycznej)
- wg liczebności i częstości występowania – do oceny zastosowano podział zaproponowany przez Gutowskiego (1995) z pewnymi modyfikacjami (ryc. 1.):
- liczebność przyjęto na podstawie średniej liczby osobników danego gatunku odłowionych na przestrzeni dwóch lat na jedną osobę; zastosowano następującą skalę:
nieliczny: 0,1 – 4,9 osobników,
mało liczny: 5,0 – 9,9 osobników,
liczny: 10,0 – 19,9 osobników,
bardzo liczny: > 20 osobników,
- częstość występowania przyjęto szacunkowo na podstawie liczby miejsc stwierdzenia, tj. rzadki: od 1 do 3 miejsc i częsty: powyżej 3 miejsc; liczby miejsc stwierdzenia skorelowano z długością prowadzonych badań, dostępną literaturą i dotychczasową wiedzą na temat badanej rodziny chrząszczy.
Z uwagi na duże zróżnicowanie gatunkowe kózkowatych i istotne różnice klimatyczne między częścią kontynentalną a Peloponezem, wyżej wymienione podziały zostały zastosowane oddzielnie dla każdej z części.
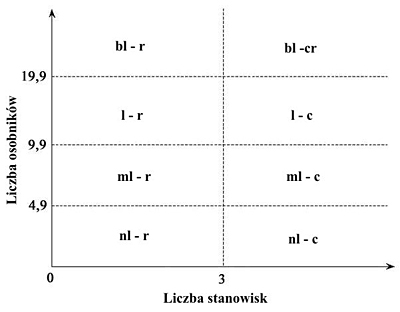
Ryc. 1. Graficzna interpretacja określająca liczebność i częstość występowania kózkowatych na terenie Grecji.
Zebrany materiał faunistyczny znajduje się w prywatnych kolekcjach autorów, a także część okazów w zbiorze porównawczym Zakładu Ochrony Lasu Instytutu Badawczego Leśnictwa w Sękocinie Starym.
WYNIKI
Podczas trzyletnich badań odnotowano 106 gatunków kózkowatych, w tym dwa nowe dla terenu Grecji oraz siedem endemitów, co łącznie stanowi 32,12% fauny Grecji (Tab. 1).
|
Lp.
|
Podrodzina/
|
rok i miejsce stwierdzenia
|
sposób stwierdzenia gatunku
|
wysokość stwierdzenia n.p.m.
|
częstość i liczność występowania
|
wykazał
|
|
Gatunek
|
|
|
2007
|
2008
|
2009
|
|
Lepturinae
|
|
|
1.
|
Rhamnusium bicolor bicolor (Schrank, 1781)
|
|
K
|
|
L
|
N
|
nl – r
|
K.L.
|
|
2.
|
Dinoptera (Dinoptera) collaris (Linnaeus, 1758)
|
K
|
K
|
|
L
|
W
|
nl – r
|
R.P., K.L., P.G.
|
|
3.
|
Cortodera humeralis aspromontana Müller, 1948
|
|
P
|
P
|
L, S, U
|
W
|
bl – c
|
R.P., K.L., P.G.
|
|
4.
|
Cortodera steineri Sama, 1997
|
|
P
|
P
|
L
|
G, WG
|
bl – r
|
R.P., P.G.
|
|
5.
|
Cortodera holosericea (Fabricius, 1801)
|
|
K
|
|
L
|
WG
|
bl – r
|
R.P., K.L., P.G.
|
|
6.
|
Grammoptera (Grammoptera) ruficornis ruficornis (Fabricius, 1801)
|
|
P
|
|
L
|
W
|
nl – r
|
R.P., P.G.
|
|
7.
|
Grammoptera (Grammoptera) auricollis bipustulata Steiner, 1975
|
|
P
|
P
|
L, U
|
W
|
l – c
|
R.P., K.L., P.G.
|
|
8.
|
Alosterna tabacicolor tabacicolor (De Geer, 1775)
|
K
|
K,P
|
P
|
L
|
G
|
nl – r
|
R.P., K.L.,P.G.
|
|
9.
|
Alosterna pauli Pesarini, Rapuzzi et Sabbadini, 2004
|
|
P
|
|
L, U
|
W
|
l – r
|
R.P., K.L., P.G.
|
|
10.
|
Vadonia dojranensis mahri Holzschuh, 1986
|
K
|
|
|
L
|
W
|
nl – r
|
R.P., K.L.
|
|
11.
|
Vadonia bisignata bisignata (Brullé, 1832)
|
|
K
|
K, P
|
L
|
W
|
l – c
|
R.P., K.L., P.G.
|
|
12.
|
Pseudovadonia livida livida (Fabricius, 1776)
|
K
|
K
|
P
|
L
|
W
|
nl – c
|
R.P., K.L., P.G.
|
|
13.
|
Anoplodera sexguttata (Fabricius, 1775)
|
|
K
|
P
|
L
|
W
|
ml – r
|
R.P., K.L., P.G.
|
|
14.
|
Stictoleptura cordigera cordigera (Füsslins, 1775)
|
|
K
|
P
|
L
|
N
|
nl – r
|
R.P., K.L., P.G.
|
|
15.
|
Stictoleptura rufa (Brullé, 1832)
|
|
|
P
|
L
|
W
|
ml – r
|
R.P., K.L., P.G.
|
|
16.
|
Stictoleptura pallens (Brullé, 1832)
|
K
|
P
|
P
|
L
|
N, W
|
bl – c
|
R.P., K.L., P.G.
|
|
17.
|
Anastrangalia dubia dubia (Scopoli, 1763)
|
|
K, P
|
P
|
L
|
W, G
|
l – c
|
R.P., K.L., P.G.
|
|
18.
|
Pedostrangalia (Neosphenalia) verticalis (Germar, 1822)
|
K
|
P
|
P
|
L
|
N, W
|
ml – c
|
R.P., K.L., P.G.
|
|
19.
|
Pachytodes erraticus erraticus (Dalman, 1817)
|
|
K
|
P
|
L
|
W
|
nl – r
|
R.P., K.L., P.G.
|
|
20.
|
Rutpela maculata maculata (Poda, 1761)
|
K
|
K
|
P
|
L
|
W
|
nl – r
|
R.P., K.L., P.G.
|
|
21.
|
Stenurella melanura (Linnaeus, 1758)
|
K
|
K
|
|
L
|
W
|
nl – r
|
P.G.
|
|
22.
|
Stenurella bifasciata bifasciata (Müller, 1776)
|
|
P
|
P
|
L
|
W
|
nl – r
|
R.P., P.G.
|
|
23.
|
Stenurella nigra (Linnaeus, 1758)
|
|
|
P
|
L
|
W
|
nl – r
|
R.P., P.G.
|
|
24.
|
Stenurella septempunctata septempunctata (Fabricius, 1792)
|
K
|
K
|
P
|
L
|
W
|
l – r
|
R.P., K.L., P.G.
|
|
Spondylinae
|
|
|
25.
|
Spondylis buprestoides (Linnaeus, 1758)
|
|
K
|
|
L
|
N
|
nl – r
|
R.P.
|
|
Cerambycinae
|
|
|
26.
|
Icosium tomentosum atticum Ganglbauer, 1882
|
|
|
P
|
B
|
W
|
nl – r
|
R.P., P.G.
|
|
27.
|
Aromia moschata moschata (Linnaeus, 1758)
|
K
|
|
|
B
|
W
|
nl – r
|
K.L.
|
|
28.
|
Trichferus pallidus (Olivier, 1790)
|
K
|
|
|
B
|
W
|
nl – r
|
K.L., P.G.
|
|
29.
|
Trichoferus fasciculatus fasciculatus (Faldermann, 1837)
|
|
P
|
|
B
|
N
|
nl – r
|
R.P.
|
|
30.
|
Molorchus minor minor (Linnaeus, 1758)
|
|
P
|
P
|
L, U
|
W, G
|
bl – c
|
R.P., K.L., P.G.
|
|
31.
|
Brachypteroma ottomanum Heyden, 1863
|
|
P
|
P
|
L, S, U
|
W, G
|
bl – c
|
R.P., K.L., P.G.
|
|
32.
|
Stenopterus flavicornis Küster, 1846
|
|
|
P
|
L
|
N
|
nl – r
|
R.P., K.L., P.G.
|
|
33.
|
Stenopterus rufus geniculatus Kraatz, 1863
|
K
|
P
|
P
|
L
|
N, W
|
ml – c
|
R.P., P.G.
|
|
34.
|
Stenopterus atricornis Pic, 1891
|
|
K
|
P
|
L, S
|
W, G
|
ml – r
|
R.P., K.L., P.G.
|
|
35.
|
Callimus (Callimus) angulatus angulatus (Schrank, 1789)
|
K
|
|
|
L
|
L
|
ml – r
|
R.P., K.L., P.G.
|
|
36.
|
Lampropterus (Lampropterus) femoratus (Germar, 1824)
|
|
K
|
|
L
|
G
|
nl – r
|
R.P., K.L., P.G.
|
|
37.
|
Callimoxys gracilis (Brullé, 1832)
|
K
|
P
|
P
|
L
|
W, G
|
bl – c
|
R.P., K.L., P.G.
|
|
38.
|
Obrium brunneum (Fabricius, 1792)
|
|
P
|
|
L
|
G
|
nl – r
|
R.P.
|
|
39.
|
Stenhomalus (Obriopsis) bicolor (Kraatz, 1862)
|
|
P
|
P
|
L, U
|
W, G
|
bl – c
|
R.P., K.L., P.G.
|
|
40.
|
Deilus fugax (Olivier, 1790)
|
|
P
|
P
|
L,B
|
W
|
nl – r
|
R.P., K.L., P.G.
|
|
41.
|
Cerambyx scopolii Fuessly, 1775
|
K
|
K
|
|
L
|
G
|
l – r
|
R.P., K.L., P.G.
|
|
42.
|
Purpuricenus (Purpuricenus) kaehleri kaehleri (Linnaeus, 1758)
|
K
|
K, P
|
|
L, B
|
W
|
nl – r
|
R.P., K.L., P.G.
|
|
43.
|
Purpuricenus (Purpuricenus) budensis (Götz, 1783)
|
|
P
|
P
|
L
|
N, W
|
ml – c
|
R.P., K.L., P.G.
|
|
44.
|
Purpuricenus (Purpuricenus) dalmatinus Sturm, 1783
|
|
|
P
|
S
|
|
nl – r
|
P.G
|
|
45.
|
Purpuricenus (Purpuricenus) desfontainei inhumeralis Pic, 1891
|
|
P
|
K, P
|
L, B
|
N, W
|
bl – c
|
R.P., K.L., P.G.
|
|
46.
|
Calchaenesthes oblongomaculata (Guérin-Meneville, 1844)
|
|
P
|
K, P
|
L, S, U
|
W
|
ml – c
|
R.P., K.L., P.G.
|
|
47.
|
Ropalopus (Ropalopus) clavipes (Fabricius, 1775)
|
|
P
|
|
B
|
N
|
nl – r
|
R.P., K.L., P.G.
|
|
48.
|
Phymatodes (Phymatodellus) rufipes (Fabricius, 1776)
|
|
P
|
P
|
L, S, U
|
W
|
l – c
|
R.P., K.L., P.G.
|
|
49.
|
Anaglyptus (Anaglyptus) luteofasciatus Pic, 1905
|
|
P
|
P
|
L, S, U
|
G
|
ml – r
|
R.P., K.L., P.G.
|
|
50.
|
Xylotrechus (Xylotrechus) antilope antilope (Schönherr, 1817)
|
|
K
|
|
L
|
W
|
nl – r
|
R.P., K.L., P.G.
|
|
51.
|
Xylotrechus (Xylotrechus) arvicola Olivier, 1795
|
|
K
|
|
L
|
N
|
nl – r
|
K.L.
|
|
52.
|
Xylotrechus (Xylotrechus) stebbingi Gahan, 1906
|
|
P
|
P
|
L, A
|
N
|
ml – c
|
R.P., K.L, P.G.
|
|
53.
|
Rusticoclytus rusticus (Linnaeus, 1758)
|
|
P
|
|
L
|
W
|
nl – r
|
R.P.
|
|
54.
|
Plagionotus floralis (Pallas, 1833)
|
|
K
|
P
|
L
|
N
|
ml – r
|
K.L, P.G.
|
|
55.
|
Chlorophorus figuratus (Scopoli, 1763)
|
K
|
K
|
|
L
|
W
|
nl – r
|
R.P., K.L.
|
|
56.
|
Chlorophorus hungaricus (Fabricius, 1781)
|
|
K
|
|
L
|
G
|
nl – r
|
K.L.
|
|
57.
|
Chlorophorus sartor (Müller, 1766)
|
|
|
K, P
|
L
|
N, W
|
nl – r
|
R.P., K.L, P.G.
|
|
58.
|
Clytus arietis arietis (Linnaeus, 1758)
|
|
|
P
|
L
|
G
|
nl – r
|
R.P.
|
|
59.
|
Clytus rhamni Germar, 1817
|
K
|
K, P
|
P
|
L
|
W
|
ml – c
|
R.P., K.L., P.G.
|
|
Lamiinae
|
|
|
60.
|
Mesosa (Mesosa) curculionoides Linnaeus, 1761
|
|
K
|
|
L
|
N
|
nl – r
|
P.G.
|
|
61.
|
Mesosa (Aphelocnemia) nebulosa nebulosa Fabricius, 1781
|
|
K
|
|
L,B
|
W
|
nl – r
|
R.P., K.L., P.G.
|
|
62.
|
Parmena pubescens pilosa Brullé, 1832
|
|
P
|
P
|
B
|
N, W
|
ml – r
|
R.P., K.L., P.G.
|
|
63.
|
Parmena novaki Sama, 1996
|
|
P
|
P
|
B
|
N
|
bl – r
|
R.P., K.L., P.G.
|
|
64.
|
Herophila tristis tristis (Linnaeus, 1767)
|
|
K
|
|
L
|
WG
|
nl – r
|
R.P., K.L., P.G.
|
|
65.
|
Morimus asper asper (Sulzer, 1776)
|
|
K, P
|
|
L,B
|
W, G
|
ml – r
|
R.P., K.L., P.G.
|
|
66.
|
Dorcadion (Cribridorcadion) thessalicum thessalicum Pic, 1916
|
K
|
K
|
|
L
|
W, G
|
l – r
|
R.P., K.L., P.G.
|
|
67.
|
Dorcadion (Cribridorcadion) bravardi Pic, 1916
|
|
K
|
|
L
|
WG
|
bl – r
|
R.P., K.L., P.G.
|
|
68.
|
Dorcadion (Cribridorcadion) eugeniae eugeniae Ganglbauer, 1886
|
|
P
|
P
|
L
|
WG
|
ml – r
|
R.P., K.L., P.G.
|
|
69.
|
Dorcadion (Cribridorcadion) eugeniae emgei Ganglbauer, 1886
|
|
|
P
|
L
|
WG
|
nl – r
|
P.G.
|
|
70.
|
Dorcadion (Cribridorcadion) krueperi Ganglbauer, 1884
|
|
K
|
|
L
|
WG
|
nl – r
|
P.G.
|
|
71.
|
Dorcadion (Cribridorcadion) peloponesium Pic, 1902
|
|
P
|
|
L
|
G
|
nl – r
|
K.L.
|
|
72.
|
Docadion (Cribridorcadion) ossae Heyrovsky, 1941
|
|
K
|
|
L
|
WG
|
ml – r
|
R.P., K.L., P.G.
|
|
73.
|
Dorcadion (Cribridorcadion) xerophilum Pesarini et Sabbadini, 2007
|
K
|
|
|
L
|
W
|
nl – r
|
K.L.
|
|
74.
|
Neodorcadion bilineatum Germar, 1824
|
K
|
K
|
|
L
|
W
|
ml – r
|
R.P., P.G.
|
|
75.
|
Neodorcadion virleti Brullé, 1832
|
|
P
|
|
L
|
W
|
nl – r
|
K.L.
|
|
76.
|
Niphona (Niphona) picticornis Mulsant, 1839
|
|
P
|
|
B
|
N,W
|
nl – r
|
R.P., K.L.
|
|
77.
|
Pogonocherus (Pogonocherus) hispidulus (Piller et Mitterpacher, 1783)
|
|
P
|
|
L
|
W
|
nl – r
|
R.P.
|
|
78.
|
Acanthocinus aedilis (Linnaeus, 1758)
|
|
K
|
|
L
|
G
|
nl – r
|
R.P.
|
|
79.
|
Exocentrus adspersus Mulsant, 1846
|
|
K
|
|
L
|
W,G
|
nl – r
|
R.P., K.L.
|
|
80.
|
Exocentrus punctipennis Mulsant et Guillebeau, 1856
|
|
K
|
|
B
|
N
|
l – r
|
R.P., P.G.
|
|
81.
|
Aegomorphus clavipes (Schrank, 1781)*
|
K
|
|
|
L, A
|
N
|
nl – r
|
K.L.
|
|
82.
|
Aegomorphus krueperi (Kraatz, 1859)
|
K
|
K
|
|
L,B
|
W
|
bl – r
|
R.P., K.L., P.G.
|
|
83.
|
Saperda punctata (Linnaeus, 1767)
|
|
K
|
|
B
|
N
|
ml – r
|
R.P., K.L., P.G.
|
|
84.
|
Saperda quercus quercus Charpantier, 1825
|
|
K
|
P
|
S, U
|
W
|
ml – r
|
R.P., K.L., P.G.
|
|
85.
|
Oberea (Amaurostoma) taygetana Pic, 1901
|
|
P
|
P
|
L, S
|
W
|
l – c
|
R.P., K.L., P.G.
|
|
86.
|
Mallosia (Mallosia) graeca (Sturm, 1843)
|
|
|
P
|
L
|
W
|
l – r
|
R.P., K.L., P.G.
|
|
87.
|
Oxylia duponcheli (Brullé, 1832)
|
K
|
K, P
|
K, P
|
L, S
|
N, W
|
l – c
|
R.P., K.L., P.G.
|
|
88.
|
Phytoecia (Pilemia) hirsutula hirsutula (Frölich, 1793)
|
K
|
K
|
|
L, S
|
W
|
ml – c
|
R.P., K.L., P.G.
|
|
89.
|
Phytoecia (Pilemia) angusterufonotata Pic, 1952
|
|
|
P
|
S
|
W
|
nl – r
|
R.P., K.L.
|
|
90.
|
Phytoecia (Helladia) flavescens (Brullé, 1832)
|
K
|
K, P
|
P
|
S
|
W, G
|
ml – c
|
R.P., K.L., P.G.
|
|
91.
|
Phytoecia (Musaria) affinis affinis (Harrer, 1784)
|
|
P
|
|
L
|
|
nl – r
|
P.G.
|
|
92.
|
Phytoecia (Phytoecia) icterica (Schaller, 1783)
|
|
P
|
P
|
L
|
W
|
nl – r
|
R.P., P.G.
|
|
93.
|
Phytoecia (Phytoecia) caerulea caerulea (Scopoli, 1772)
|
K
|
|
|
L
|
N
|
nl – r
|
K.L, P.G.
|
|
94.
|
Phytoecia (Phytoecia) caerulea baccueti (Brullé, 1832)
|
|
|
P
|
S
|
W
|
nl – r
|
R.P., P.G.
|
|
95.
|
Phytoecia (Phytoecia) pustulata pustulata (Schrank, 1776)
|
K
|
K
|
|
S
|
W, G
|
nl – r
|
R.P., K.L., P.G.
|
|
96.
|
Phytoecia (Phytoecia) virgula (Charpantier, 1825)
|
K
|
|
P
|
S
|
W
|
nl – r
|
R.P., K.L., P.G.
|
|
97.
|
Phytoecia (Phytoecia) pubescens Pic, 1895
|
K
|
K
|
P
|
S
|
N, W
|
ml – r
|
R.P., K.L., P.G.
|
|
98.
|
Phytoecia (Opsilia) coerulescens (Scopoli, 1763)
|
K
|
K, P
|
K,P
|
L,S
|
N, W, G
|
l – c
|
R.P., K.L., P.G.
|
|
99.
|
Phytoecia (Opsilia) molybdaena (Dalman, 1817)*
|
|
P
|
|
S
|
G
|
nl – r
|
R.P.
|
|
100.
|
Calamobius filum (Rossi, 1790)
|
K
|
K
|
P
|
S,L
|
N, W
|
bl – c
|
R.P., K.L., P.G.
|
|
101.
|
Agapanthia (Epoptes) kirbyi Gyllenhal, 1817
|
|
K
|
P
|
L
|
G
|
nl – r
|
R.P., K.L., P.G.
|
|
102.
|
Agapanthia (Epoptes) asphodeli (Latreille, 1804)
|
|
|
P
|
S
|
W
|
nl – r
|
K.L.
|
|
103.
|
Agapanthia (Epoptes) cynarae cynarae (Germar, 1817)
|
K
|
K, P
|
K, P
|
L
|
N, W
|
bl – c
|
R.P., K.L., P.G.
|
|
104.
|
Agapanthia (Agapanthia) cardui (Linnaeus, 1767)
|
K
|
P
|
P
|
L, S
|
N, W
|
nl – c
|
R.P., K.L., P.G.
|
|
105.
|
Agapanthia (Agapanthia) violacea (Fabricius, 1775)
|
|
P
|
P
|
L,S
|
N, W
|
nl – r
|
R.P., K.L., P.G.
|
|
106.
|
Agapanthiola leucaspis (Steven, 1817)
|
K
|
K
|
|
S
|
N
|
ml – r
|
R.P., P.G.
|
* nowe gatunki dla fauny Grecji; K – część kontynentalna Grecji, P – Peloponez
Spośród wszystkich stwierdzonych gatunków na dokładniejsze omówienie zasługują wybrane, o których autorzy pragną uzupełnić dotychczasowe informacje.
Cortodera humeralis aspromontana Mül.
Podgatunek w Europie znany tylko z Grecji i Włoch (Sama 2002). W Grecji występuje we wschodniej i centralnej części Peloponezu (Pesarini i Sabbadini 2007). Stwierdzony został blisko miejscowości: Arkadia: Ágios Pétros, Ástros, Kardara ad Trípoli, Alonistena ad Vitina; Lakonia: Kariés; Kotynthia: Kaliáni, Káto Tarsós, Mossiá ad Goúra. Imagines pobierały pyłek z kwiatostanów dębowych Quercus coccifera L. Obie płcie tego podgatunku są koloru brązowożółtego. Wraz z nim występuje podgatunek nominatywny, u którego niektóre osobniki różnych płci mają czarne pokrywy z dwiema pomarańczowymi plamami u ich nasady. Podczas badań sporadycznie obserwowano kopulację miedzy dwoma podgatunkami.
Cortodera steineri Sama
W Europie gatunek znany jedynie z terenów Grecji, a niedawno stwierdzony także w Turcji (Özdikmen i Turgut 2008a, Özdikmen i in. 2009). Znaleziony został na Peloponezie w prowincjach: Arkadia: Alonistena ad Vitina; Koryntia: Sarantápiho ad Evrostina (1300m n.p.m.); Achaia: Helmos Mts. (Kalavrita). Imagines żerowały na Centaurea triumfettii All. pobierając z nich pyłek kwiatowy.
Cortodera holosericea (F.)
Gatunek szeroko rozmieszczony, znany z Włoch, Austrii, Bośni i Hercegowiny, Serbii i Montenegro, Czech, Słowacji, Rumunii, Węgier, Bułgarii, Chorwacji, Niemiec, Ukrainy, Słowenii, południowej części Rosji, Kaukazu i Turcji (Sama 2002, Simandl 2002, Özdikmen 2007, Miroshnikov 2009, Sama i Löbl 2010a). W Grecji stwierdzony został na północno-zachodnim stoku masywu Olimp na wysokości 1500m n.p.m. Imagines (ryc. 2.) żerowały na Centaurea triumfettii All., pobierając z nich pyłek kwiatowy.

Ryc. 2. C. holosericea w różnych formach barwnych (fot. W. Janiszewski).
Alosterna pauli Pes., Rap. et Sab.
Gatunek jest endemitem Greckim, znanym z północnej i środkowej części Peloponezu (Pesarini i Sabbadini 2004). Nowe stanowisko pochodzi ze wschodniej części – 20km na zachód od Ástros w kierunku Ágios Pétros (prowincja Arkadia). Z obserwacji własnych wynika, że gatunek związany jest troficznie z dębem Q. coccifera L. i głogiem Crataegus L. sp., z których imagines bardzo chętnie pobierają pyłek kwiatowy.
Grammoptera auricollis bipustulata Steiner
Początkowo opisany przez Steinera (1975) jako osobny gatunek G. bipustulata. Następnie Sláma (1997) nadał mu status podgatunku w ramach znanego wcześniej gatunku G. auricollis Mulsant et Rey, 1863, który jest endemitem w południowej części Grecji (Peloponez). Znane są jeszcze inne podgatuneki: G. auricollis basicornis Pic, 1924 z Krety, G. auricollis samai Sláma, 1997 z Algierii i Tunezji oraz G. auricollis auricollis Mulsant & Rey, 1863 z Algierii.
Znaleziony został we wschodniej i środkowej części Peloponezu w prowincjach: Arkadia: Ástros, Ágios Pétros, Alonistena ad Vitina; Lakonia: Kariés. Imagines żerowały na kwiatostanach dębowych Quercus coccifera L.
Vadonia dojranensis mahri Holz.
Podgatunek znany z Grecji i Macedonii (Sama i Löbl 2010a). Znaleziony został 10km na północny-zachód od miejscowości Aridea. Imagines pobierały pokarm z kwiatów z rodzaju Euphorbia L. sp. Stanowisko to znajdowało się na terenie otwartym, miejscami porośniętym około 1m wilczomleczem. Na podobnym stanowisku w 2006 roku w Bułgarii (Rožen) autorzy mieli możliwość odławiać ten sam podgatunek.
Vadonia bisignata bisignata (Brullé)
Podgatunek znany z Grecji i Bułgarii (Pesarini i Sabbadini 2007). Znaleziony na Peloponezie: Arkadia: Skopí ad Trípoli; Argolida: 5km za Mílí w kierunku Trípoli i w części kontynentalnej: Ftiotyda: Kalógiri (Pindos Mts.), Malandrino ad Lidoríki. Imagines pobierały pokarm z kwiatów Euphorbia L. sp., Carduus L. i Rosaceae.
Brachypteroma ottomanum Heyden
Gatunek znany z Włoch (także Sycylii), Szwajcarii, Chorwacji, Albanii, Grecji, Bułgarii, Azerbejdżanu, wschodniej i południowej Turcji (Özdikmen 2008, Sama i Löbl 2010b). Znaleziony został w prowincjach: Arkadia: Alonistena ad Vitina, Trípoli; Lakonia: Kariés. Imagines intensywnie żerowały na kwiatach głogu Crataegus L. sp.
Porównując okazy z francuskimi i włoskimi, to greckie osobniki mają wyraźnie jednobarwne nogi, gdzie na pierwszy rzut oka wydają się ciemniejsze.
Stenopterus atricornis Pic
Gatunek w Europie znany jedynie z Grecji (Sláma i Slámová 1996), a poza nią jeszcze z Turcji (Adlbauer 1988). Znaleziony w części północnej: Trikala: Meteora, Larisa: Olimp Mts. i na Peloponezie: Lakonia: Trípi ad Spartí. Imagines żerowały i kopulowały na kwiatach baldaszkowatych z rodzaju Daucus L. Podczas połowu temperatura powietrza była bardzo wysoka i wynosiła około 30ºC.
Calchaenesthes oblongomaculata (Guérin)
Podgatunek znany z Grecji, Bułgarii i Rumunii, a także z Cypru, Turcji i Jordanu (Berger 2005, Sama i Löbl 2010b). Znaleziony został na Peloponezie w prowincjach: Arkadia: Ágios Pétros; Lakonia: Kariés, Kotynthia: Káto Tarsós i na części kontynentalnej: Fokida: Malandrino ad Lidoríki. W 2008 roku imagines obserwowano, jak nalatywały na opalone przez ogień pnie dębów Quercus coccifera L. W następnym roku stwierdzano poszczególne osobniki na dębach z wyraźnymi śladami defoliacji od szkodników liściożernych. Wnioskować można, że gatunek posiada zdolności pyrofilne i zasiedla drzewa osłabione przez różne czynniki. Największą aktywność tego gatunku obserwowano w temperaturze powyżej 30ºC, gdzie osobniki preferowały wierzchołkowe partie drzew. Poniżej tej temperatury imagines siedziały nieruchomo na liściach dolnych gałęzi dębowych.
Anaglyptus (A.) luteofasciatus Pic
Gatunek jest endemitem Greckim (Sama i Löbl 2010b). Znaleziony został w środkowym Peloponezie: Arkadia: Alonistena ad Vitina. Imagines nie wykazywały chęci lotu i przebywały głównie na pędach i spodnich stronach liści. Jedynie w na krótki czas imagines wyłaniały się i pobierały pyłek z kwiatów głogu Crataegus L. sp., gdzie były wówczas widoczne. Najlepszą metodą połowu tego gatunku jest otrząsanie na parasol entomologiczny.
Xylotrechus (X.) stebbingi Gahan
Gatunek zawleczony do Europy z Tybetu – Himalaje (Vitali 2004) i znany już z Francji, Włoch, Słowenii, Niemiec, Grecji (w tym również Krety) i Szwajcarii (Kohler 2000, Sama 2002, Teunissen 2002, Brelih i in. 2006, Danilevsky 2011). Należy do oligofagów gatunków liściastych, gdzie rozwija się na: Quercus ssp., Morus L. ssp., Ficus carica L., Alnus Mill. spp., Populus L. spp., Salix L. spp., Ulmus L. spp., Koelreuteria paniculata Laxm., Celtis australis L. i Robinia pseudoacacia L. (Rapuzzi 2002, Sama 2002). Znaleziony został w prowincji Argolida: nadmorska miejscowość Toló. Imagines po zachodzie Słońca zachowywały się bardzo aktywnie. Biegały wzdłuż po pniach R. pseudoacacia i kopulowały ze sobą. Znalezione zostały podczas przeglądania pni przy użyciu sztucznego źródła światła.
Z przeprowadzonej hodowli wynika, że gatunek ten jest niewymagający pod względem wilgotnościowym, jak i zasiedlanego materiału drzewnego. Bardzo chętnie rozwija się w miękkim drewnie Sambucus nigra L., gdzie cykl rozwojowy (w najkrótszym czasie) w warunkach laboratoryjnych trwa niecały rok. Rozwój larw z jaj złożonych w tym samym czasie przebiega nierównomiernie. Gdy część imagines opuszcza już kolebki poczwarkowe, to inne są jeszcze w początkowym stadium larwy. Taki rozciągły rozwój, wpływa korzystnie na przetrwanie gatunku w bardzo niesprzyjających warunkach. Można też przypuszczać, że gatunek o takiej strategii życiowej, z łatwością przystosowuje się do różnych warunków środowiskowych, co tłumaczy jego obecność na terenie Europy.
W naturalnych warunkach X. stebbingi odbywa dwuletni cykl rozwojowy (Sama i in. 2010).
Parmena novaki Sama
Gatunek jest endemitem Greckim (Sama i Löbl 2010c). Dotychczasowe znaleziska wskazują, że rozmieszczony jest wzdłuż Kanału Korynckiego, zarówno w części kontynentalnej: Fokida, jak i na Peloponezie: Korynthia (Sama 1996). Nowe stanowiska pochodzą z południowej części Peloponezu: Lakonia: Neo Ítilo ad Areópolis i wschodniej Argolida: Drepano ad Nafplio. Imagines pozyskano drogą hodowli z wilczomlecza Euphorbia dendroides L., jak i Euphorbia characias wulfenii (Hoppe).
Część imagines była już przeobrażona w kolebkach poczwarkowych i gotowa do opuszczenia żerowisk, a pozostałe wyhodowano z poczwarek i larw znajdujących się w drewnie. Larwa początkowo żeruje między korą a drewnem, silnie naruszając biel. Następnie część z nich wgryza się w drewno i tam tworzone są kolebki poczwarkowe. Inne tworzą je na powierzchni drewna pod korowiną. Imagines wychodzą wcześniej wygryzionym, okrągłym otworem o średnicy około 4,5mm. Otwór wejściowy zatkany jest zatyczką z długich wiórków (ryc. 3.). Postacie doskonałe przebywają zazwyczaj na materiale lęgowym, chowając się za dnia we własne otwory wylotowe. Prowadzą nocny tryb życia. Imagines odżywiają się korowiną obumierających roślin żywicielskich. W warunkach laboratoryjnych przeżywają ponad rok.

Ryc. 3. Obraz żerowania P. novaki na pędzie głównym E. dendroides (fot. W. Janiszewski).
Parmena pubescens pilosa Brullé
Podgatunek znany z Albanii, Chorwacji, Bośni i Hercegowiny, Grecji, Włoch i Słowenii (Sama i Löbl 2010c). Znaleziony został na Peloponezie w prowincjach: Lakonia: Neo Ítilo ad Areópolis, 20km W od Spárti, Argolida: Drepano ad Nafplio. Imagines, larwy i poczwarki hodowano z około 1cm grubości, usychających pędów Euphorbia characias wulfenii (Hoppe). Pędy zasiedlane były na około 1/3 wysokości od gruntu. Samica do składania jaj wybiera pędy znajdujące się w zwartej (środkowej) części rośliny, które nie są bezpośrednio narażane na słońce. Larwy po wykluciu się z jaj, żerują początkowo (krótko) na powierzchni pędu między korowiną a drewnem, a następnie wgryzają się do środka pędu, żerując przez cały okres wzdłuż rdzenia. Pędy usychając – drewnieją. Niektóre osobniki potrafią cały cykl odbyć na powierzchni pędu, naruszając tylko biel. Kolebka poczwarkowa (o wymiarach 14 mm × 5,5 mm) tworzona jest zazwyczaj wzdłuż rdzenia (ryc. 4.), choć niekiedy (u mniejszych osobników) w części obwodowej. Imagines wygryzają się okrągłym otworem o średnicy około 5mm. Imagines prowadzą nocny tryb życia i jak u poprzedniego gatunku stwierdzono również, że długość życia w warunkach laboratoryjnych przekracza rok czasu. Inne znane rośliny żywicielskie to: E. dendroides L., Crithmum maritimum L., Foeniculum vulgare Mill., Ferula communis L., Thapsia garganica L., Ammi visnaga (L.), Chrysanthemum L. sp., Papaver somniferum L., Carduaceae, a także drzewiaste Ficus carica L. i Nerium oleander L. (Bense 1995).

Ryc. 4. Kolebka poczwarkowa P. pubescens pilosa w pędzie E. characias wulfenii (fot. W. Janiszewski).
Morimus asper asper (Sulzer)
Podgatunek znany z Albanii, Chorwacji, Francji, Grecji, Włoch, Hiszpanii, Szwajcarii Serbii i Montenegro (Sama i Löbl 2010c). Znaleziony został we wschodniej części Peloponezu: Arkadia: Ágios Pétros i w części kontynentalnej: Ftiotyda: Kalógiri (Pindos Mts.). Imagines przesiadywały na grubych drewnianych kłodach Populus L. sp. od strony podłoża (strona zacieniona). Znajdowane były również w przydomowych stosach drewna na opał Quercus, jak również siedzące u podstawy pnia Abies cephalonica Loudon. Ponadto pozyskano (Pindos Mts.) z drewna stosowego jodły Abies cephalonica Loudon larwy do hodowli. Znajdowały się one w hakowatych kolebkach poczwarkowych umieszczonych w drewnie na głębokości około 1-3cm. Po niecałych trzech tygodniach uzyskano imagines. Długość życia w warunkach laboratoryjnych wyniosła prawie półtora roku (16 miesięcy). Postacie doskonałe podczas hodowli odżywiały się młodymi fragmentami korowiny drzew i krzewów liściastych, a także ogonkami, rzadziej blaszkami liściowymi. Chętnie zjadały owoce, takie jak jabłko czy banan. Z obserwacji własnych wynika, że imagines największą aktywność wykazują w godzinach wieczornych i nocnych. Samice po około dwóch tygodniach żeru uzupełniającego są gotowe do kopulacji. Wcześniejsze próby zbliżenia kończyły się dla samców utratą części czułków lub odnóży. Samce konkurując o względy samicy doprowadzają do potyczek, z których równie często wychodzą pokaleczone. Po kopulacji samica rozpoczyna składanie jaj, z których po okresie inkubacji wylęgają się larwy. Żerowanie odbywa się głównie w korowinie, z rzadka naruszając biel, jednak gdy zasiedlony materiał jest drobniejszy (wyhodowano imago z gałęzi o średnicy 3cm) to żerują w bielu. W trakcie rozwoju larwy często wypadają poza żerowisko, co nie stwarza temu gatunkowi żadnego problemu. Podobnie jak larwy Prionus coriarius (L.) przemieszczają się w podłożu poszukując pokarmu i wtedy ponownie wgryzają się w materiał, z którego wypadły. Intensywne żerowanie w ciągu sezonu powoduje, że larwy osiągają długość 5-8cm. Również godnymi uwagi obserwacjami larw M. asper asper były ich wyjątkowe zdolności odpornościowe na wszelkiego rodzaju infekcje. Zaobserwowano larwy, które w wyniku starcia w żerowisku z innymi osobnikami, posiadały zabliźnione rany i nadal funkcjonowały bez przeszkód kontynuując swój rozwój.
Cały cykl rozwojowy łącznie z przechłodzeniem w temperaturze 3-5°C trwającym około 3 miesięcy może zamknąć się w jednym roku. Do hodowli laboratoryjnych użyto wyrzynków i gałęzi z orzecha włoskiego (Juglans regia L.).
Aegomorphus clavipes (Schrank)
Gatunek znany z większości krajów europejskich, a także z północnej części Afryki oraz Azji (Sama i Löbl 2010c). Prowadzi skryty tryb życia, a rozwija się na wielu gatunkach drzew liściastych. Najczęściej można go spotkać na materiale drzewnym, który zazwyczaj jest jego rośliną żywicielską.
W Grecji został stwierdzony w części kontynentalnej Pieria: Paralia (V 2007). Kopulującą parę odłowiono na pniu topoli Populus sp. L. przy pomocy sztucznego światła.
Aegomorphus krueperi Kraatz
Gatunek znany, jako endemit Grecki. Ostatnio błędnie wykazany został z Serbii przez Pila (2004/2005) oraz Pila i Stojanovića (2005, 2007) (Sama 2010). W Grecji został stwierdzony w prowincji Trikala: Meteora – w litych drzewostanach dębowych Quercus frainetto Tan. Znany jest także z Góry Ossa w prowincji Larisa (Berger 2005). Imagines prowadzą bardzo skryty tryb życia. Najczęściej przebywają na leżącym na ściółce, martwym materiale drzewnym, który porośnięty jest dużą ilością porostów. Ich ubarwienie sprawia, że z łatwością się do nich upodabniają – mimikra (ryc. 5.). Atrakcyjnym dla tego gatunku materiałem drzewnym było drewno silnie przegrzybione, głównie przez patogeny z rodzaju Stereum spp. Z obserwacji własnych wynika, że A. krueperi, prowadzą żer uzupełniający zgryzając fragmenty drewna przerośnięte grzybnią (zgnilizna biała-twarda), a także niekiedy fragmenty plechy porostów. Dopiero później następuje kopulacja, a jaja składane są w spękania korowiny. Podobnie zachowuje się pokrewny gatunek o podobnej biologii A. obscurior (Pic, 1904), niedawno znaleziony na terenach Polski (Hilszczański i Bystrowski 2005). Podjęte próby hodowli laboratoryjnych różnych stadiów przedimaginalnych wskazują na rozwój jednoroczny, czasami w mniej sprzyjających warunkach dwuletni. Imagines niechętnie latają, żyją krótko, około 2-3 tygodni.
 Ryc. 5. Aegomorphus krueperi na gałęzi Quercus frainetto, jako przykład mimikry (fot. K. Łoś).
Ryc. 5. Aegomorphus krueperi na gałęzi Quercus frainetto, jako przykład mimikry (fot. K. Łoś).
Saperda quercus quercus Charp.
Podgatunek nominatywny znany jest jedynie z terenów Europy: Bośni i Hercegowiny, Grecji, Bułgarii oraz Serbii i Montenegro (Sama i Löbl 2010c). W azjatyckiej części (tj. w Turcji, Syrii, Jordanie i Izraelu) występuje drugi podgatunek S. (C.) quercus ocellata Abeille de Perrin, 1895 (Adlbauer 1988, Sama i in. 2010). Oba podgatunki różnią się od siebie kolorem plam, występujących na pokrywach: podgatunek quercus posiada jasne lub lekko żółtawe plamy, a podgatunek ocellata wyraźne pomarańczowe plamy. W Grecji został stwierdzony na Peloponezie: Lakonia: Trípi ad Spartí, Kariés i w części kontynentalnej: Trikala: Meteora. Większość imagines zostało strząśniętych z dębów C. coccifera na parasol entomologiczny. Jeden okaz znaleziony został martwy zaatakowany już przez mrówki. Podczas przeglądania pni i gałęzi dębowych znalezione zostało żerowisko wraz z otworem wylotowym w żywej około 3,5cm gałęzi. Oprócz otworu wylotowego na powierzchni drewna nie ma żadnych śladów żerowania. Zaatakowane drzewo nie wytwarza również żadnych reakcji obronnych w postaci tkanki kalusowej, jak np. przy S.(C.) populnea (Linnaeus, 1758), gdzie tworzone są zgrubienia na pędzie. Z tego wynika, że hodowla niższych stadiów przedimaginalnych tego gatunku byłaby bardzo utrudniona.
Oberea (A.) taygetana Pic
Gatunek jest endemitem Greckim. Znany jest z części kontynentalnej i z Peloponezu (Sláma i Slámová 1996). Podczas badań stwierdzony został jedynie na Peloponezie na terenie prowincji: Arkadia: Kardara ad Trípoli, Skopí ad Trípoli; Lakonia: Artemíssía. We wszystkich przypadkach imagines przebywały na pędach Euphorbia characias wulfenii (Hoppe).
Mallosia (M.) graeca (Sturm)
Gatunek jest endemitem Greckim, znanym tylko z Peloponezu (Sama i Löbl 2010c). Stwierdzony został na terenie prowincji: Korynthia: Kaliáni, 5km SW Stimfalia, Káto Tarsós; Arkadia: Kardara ad Trípoli. Imagines odławiano na Eryngium campestre (L.) (Apiaceae). Nielotne samice przesiadywały na roślinie żywicielskiej, a lotne samce przylatywały do odbycia kopulacji. Obie płcie bardzo chętnie konsumowały roślinę żywicielską. Wysoka temperatura powietrza (30ºC) powodowała wzmożoną aktywność tego gatunku.
Oxylia duponcheli (Brullé)
Gatunek w Europie znany z Albanii, Macedonii, Grecji i Bułgarii (Danilevsky 2011). Znaleziony został w części kontynentalnej: Florina: 10km NW Aridea; Trikala: 5km N Meteora; Pieria: Katalónia ad Kateríni; Fokida: Dorikó ad Lidoríki, a także na Peloponezie: Argolida: 15km W za Mílí w kierunku Trípoli, 20km S od Trípoli (Tegéa); Elida: Panópoulos. Imagines przebywały na pędzie głównym Echium italicum L. (Boraginaceae), gdzie nadgryzały tkankę roślinną. Następowała tam również kopulacja. Samice były mniej lotne w porównaniu do samców. Imagines były bardzo aktywne (ruchliwe) głównie podczas wysokiej temperatury powietrza powyżej 30ºC. Rozwój tego gatunku przebiega prawdopodobnie w grubych korzeniach rośliny żywicielskiej.
Phytoecia (P.) angusterufonotata Pic
Gatunek jest endemitem Greckim, znanym tylko z Peloponezu (Holzschuh 1984). Nazwa gatunku niedawno została zmieniona przez Danilevsky’ego z nazwy inarmata (Özdikmen i Turgut 2010). Stwierdzony w prowincjach: Lakonia: Kariés: Korynthia: Kaliáni, Killini Mts.; Arkadia: Alonistena ad Vitina. Rośliną żywicielską są gatunki z rodzaju Anchusa L. (Boraginaceae). Imagines zazwyczaj przebywały szczytowych częściach roślin lub na nie nalatywały. Bardzo aktywne przy wysokich temperaturach powietrza.
Phytoecia (H.) flavescens (Brullé)
Gatunek znany z Albanii, Macedonii i Grecji (Sama i Löbl 2010c). Znaleziony został w północnej części Grecji: Larisa: Olimp Mts., a także na Peloponezie: Argolida: 15km W za Mílí w kierunku Trípoli. Imagines były bardzo aktywne w temperaturze powyżej 30ºC. Wraz z Agapanthia cynarae cynarae (Germar, 1817) nalatywały na Onopordon illyricum L. (Asteraceae), która jest rośliną żywicielską tych gatunków (Rejzek i in. 2001).
Phytoecia (Ph.) pubescens Pic
Gatunek znany w Europie z Azerbejdżanu, Armenii, Bośni i Hercegowiny, Bułgarii, Chorwacji, Grecji, Macedonii, południowej części Rosji, a także z Azji z Iranu, Izraela, Jordanu, Libanu, Syrii i Turcji (Sama i Löbl 2010c). Znaleziony został w części kontynentalnej Grecji: Larisa: 30km N od Olimp Mts., Pieria: 10 km na NW od Paralii, a także na Peloponezie, gdzie nie był wcześniej notowany: Achaia: Koúmanis. We wszystkich przypadkach został wyczerpakowany z Cichorium intybus L. (Asteraceae), która może wskazywać na roślinę żywicielską tego gatunku. Dotychczas znane rośliny żywicielskie to Carduus pycnocephalus L. i Daucus carota L. (Miksic i Kopic 1985)
Phytoecia (O.) molybdaena (Dalm.)
Gatunek bardzo szeroko rozprzestrzeniony. Niedawno zsynonimizowany został z O. longitarsis Reitter, 1911 (Sama 2002), który traktowany był jako osobny gatunek występujący jedynie na Półwyspie Iberyjskim. Najbardziej na wschód występuje w Kazachstanie, na Kaukazie, w centralnej Azji i zachodniej Syberii, a także w północnej Afryce (Algieria, Libia, Maroko i Tunezja), Iranie, Turkmenistanie, Syrii, Jordanie, Palestynie, Izraelu, a także niedawno stwierdzony z Turcji (Özdikmen i Turgut 2008b). W Europie znany z Azerbejdżanu, Armenii, Austrii, Bułgarii, Czech, Niemiec, Portugalii, Włoch, Węgier, Rumunii, Słowacji, Hiszpanii, Serbii i Montenegro, południowej części Rosji, Szwajcarii, Ukrainy (Sama i Löbl 2010c).
W Grecji znaleziony został na Peloponezie: Argolida: 10km E od Trípoli (Stenó, Agiorgitika). Imago zostało wyczerpakowane z Lithospermum purpureo-coeruleum L. W środkowej i południowej Europie gatunek ten rozwija się jeszcze na Cerinthe L. sp. i Cynoglossum L. sp. (Reitter 1911).
Podczas badań na terenie Grecji stwierdzono także Cerambycidae, których informacje o miejscu znalezienia są godne skróconego odnotowania w pracy:
Dorcadion (C.) krueperi Ganglb.; Dorcadion (C.) bravardi Pic; Dorcadion (C.) ossae Heyr. – część kontynentalna: Larisa: Olimp Mts. 1500m n.p.m.,
Dorcadion (C.) eugeniae eugeniae Ganglb. – Peloponez: Argolida: 10km E od Trípoli (Stenó, Agiorgitika); Arkadia: Menalon Mts.,
Dorcadion (C.) eugeniae emgei Ganglb. – Peloponez: Korynthia: Killini Mt.,
Dorcadion (C.) thessalicum thessalicum Pic – część kontynentalna: Trikala: 5km N od miejscowości Meteora; Ftiotyda: Pindos Mts.; Larisa: Olimp Mts. 1200m n.p.m.,
Dorcadion (C.) peloponesium Pic – Peloponez: Achaia: Helmos Mts. (Kalavrita),
Neodorcadion virleti (Brullé) – Peloponez: Arkadia: Ágios Pétros,
Niphona (N.) picticornis Muls. – (14 V 2008 – Peloponez: Argolida: 15km W od Trípoli – pozyskano materiał do hodowli ze Spartium junceum L., imago: II 2009, leg. R. Plewa),
Saperda punctata (L.) – część kontynentalna: Pieria: 10km N od Paralii (26 V 2008) – pozyskano larwy i poczwarki z wierzchnich warstw drewna i grubej korowiny Ulmus laevis Pall., imagines: VI 2008, leg. R. Plewa, K. Łoś, P. Górski).
PODZIĘKOWANIA
Autorzy składają serdeczne podziękowania Katedrze Ochrony Lasu i Ekologii SGGW–WL za pomoc w częściowym sfinansowaniu badań entomologicznych w 2008 roku. Dziękujemy również mgr Katarzynie Plewie za cierpliwość i wsparcie w powstawaniu niniejszej pracy; dr. Carlo Pesariniemu za pomoc w oznaczeniu niektórych gatunków z rodzaju Dorcadion spp. i w skompletowaniu potrzebnej literatury.
LITERATURA
ADLBAUER K. 1988: Neues zur Taxonomie und Faunistik der Bockkäferfauna der Türkei (Coleoptera, Cerambycidae). Entomofauna, 9 (12): 257-297.
BENSE U. 1995: Longhorn beetles. Illustrated Key to the Cerambycidae and Vesperidae of Europe. Markgraf Verlag, Weikersheim, 512 pp.
BERGER P. 2005: Contribution a la connaissance de la faune de Gréce: Coloptera, Cerambycidae. 3éme note. Biocosme Mésogéen, 22 (2): 81-96.
BRELIH S., DROVENIK B., PIRNAT A. 2006: Gradivo za favno hroscev (Coleoptera) Slovenije: 2. prispevek: Polyphaga: Chrysomeloidea (= Phytophaga): Cerambycidae. Scopolia, 58: 442 pp.
DANILEVSKY M. L. 2010: A check-list of Longicorn Beetles (Coleoptera, Cerambycoidea) of Europe. http://www.cerambycidae.net (updated: 23.03.2011).
GUTOWSKI J.M. 1995: Kózkowate (Coleoptera: Cerambycidae) wschodniej części Polski. Prace Instytutu Badawczego Leśnictwa, Ser. A, 811: 3-190 + wkładka.
HILSZCZAŃSKI J., BYSTROWSKI C. 2005: Aegomorphus wojtylai, a new species from Poland, with a key to European species of Aegomorphus Haldeman (Coleoptera: Cerambycidae). Genus, 16 (2): 201-207.
HOLZSCHUH C. 1984: Beschreibung neuen Arten aus der unmittelbaren verwandtschaft von Phytoecia (Pilemia) tigrina (Cerambycidae, Col.). Koleopterologische Rundschau, 57: 167-175.
KOHLER F. 2000: Erster Nachtrag zum Verzeichnis der Käfer Deutschland. Entomologische Nachrichten und Berichte, Dresden, 44 (1): 60-84.
MIKSIC R., KOPIC M. 1985: Cerambycidae Jugoslavije, III dio. Akad. nauka i umjet. Bosne i Herzegovine, Sarajewo, 62 (5): 148 pp.
MIROSHNIKOV A.I. 2009: Contribution to the knowledge of the Longicorn beatles (Coleoptera, Cerambycidae) of the Caucasus. 6. Notes on the distribution of some species with new data of their biology. Revue d’entomologie de l’URSS, 88 (4): 787-796.
ÖZDIKMEN H. 2007: The Longicorn Beetles of Turkey (Coleoptera: Cerambycidae) Part I – Black Sea Region. Munis Entomology & Zoology, 2 (2): 179-422.
ÖZDIKMEN H. 2008: The Longicorn Beetles of Turkey (Coleoptera: Cerambycidae) Part III – Aegean Region. Munis Entomology & Zoology, 3 (1): 355-436.
ÖZDIKMEN H., TURGUT S. 2008b: A review of the genus Opsilia Mulsant, 1862 (Coleoptera: Cerambycidae: Lamiinae) with a new record to the fauna of Turkey, Opsilia molybdaena (Dalman, 1817). Munis Entomology & Zoology, 3 (1): 191-198.
ÖZDIKMEN H., TURGUT S. 2008a: A new Cortodera species for Turkey (Coleoptera: Cerambycidae: Lepturinae). Munis Entomology & Zoology, 3 (2): 596-605.
ÖZDIKMEN H., TURGUT S., GÜZEL S. 2009: Longhorned beetles of Ankara Region in Turkey (Coleoptera: Cerambycidae). Munis Entomology & Zoology, 4 (1): 59-102.
ÖZDIKMEN H., TURGUT S. 2010: An overview on the Palaearctic subgenus Phytoecia (Pilemia) Fairmaire, 1864 with a new species Phytoecia (Pilemia) samii sp. n. from Turkey (Coleoptera: Cerambycidae: Lamiinae). Munis Entomology & Zoology, 5 (1): 90-108.
PESARINI C., SABBADINI A. 2004: Descrizione di due nuove specie di Lepturini di Grecia, note sulle specie affini e considerazioni sistematiche, sinonimiche e nomenclatoriali (Coleoptera, Cerambycidae). Bollettino della Societa Entomologica Italiana, 136 (2): 157-172.
PESARINI C., SABBADINI A. 2007: Notes on some longhorn beetles from Continental Greece, with description of two new subspecies (Coleoptera: Cerambycidae). Atti Soc. it. Sci. nat. Museo civ. Stor. nat. Milano. Gennaio, 148 (1): 17-34.
PIL N. 2004/2005: Checklist of longhorn beetles (Coleoptera: Cerambycidae) from Mt. Fruška Gora. Acta Entomologica Serbica, 9/10 (1/2): 105-110.
PIL N., STOJANOVIĆ D. 2005: Some rare longhorn beetles (Coleoptera: Cerambycidae) without protection on the national level found on Mt. Fruška Gora, Serbia. Archives of Biological. Sciences Belgrade, 57 (2): 137-142.
PIL N., STOJANOVIĆ D. 2007: Second contribution knowledge of longhorn beetles (Coleoptera: Cerambycidae) from Mt. Fruška Gora. Acta Entomologica Serbica, 12(1): 39-44.
RAPUZZI P. 2002: Nota su alcuni interessanti Coleoptera Cerambycidae del Carso e del Quarnaro. Lambillionea, 102 (2): 178-188.
REITTER E. 1911: Übersicht der mir bekannten Phytoecia-Arten der Untergattung Opsilia Muls. aus der palaearctischen Fauna (Col. Cerambycidae). Wiener Entomologische Zeitung, 30 (9/10): 269-271.
REJZEK M., SAMA G., ALZIAR G. 2001: Host plants of several herb-feeding Cerambycidae mainly from east Mediterranean region (Coleoptera: Cerambycidae). Biocosme Mésogéen (Nice), 2000, 17 (4): 263-294.
SAMA G. 1996: Nouveaux longicornes de Grece et du Proche Orient (Coleoptera - Cerambycidae) avec la description de trois especes nouvelles. Biocosme Mésogéen, 13 (4): 97-105.
SAMA G. 2002: Atlas of the Cerambycidae of Europe and the Mediterranean Area, Vol. I, Kabourek, Zlín, 173pp.
SAMA G. 2010: Cerambycidae – Comments on distributional information, p. 57. In: LÖBL I., SMETANA A. (ed.): Catalogue of Palaearctic Coleoptera. Apollo Books. Stenstrup, 6: 924 pp.
SAMA G., LÖBL I. 2010a: Cerambycidae, Lepturinae – Western Palaearctic taxa, eastward to Afghanistan, excluding Oman and Yemen and the countries of the former Soviet Union, pp. 95-137. In: LÖBL I., SMETANA A. (ed.): Catalogue of Palaearctic Coleoptera. Apollo Books. Stenstrup, 6: 924 pp.
SAMA G., LÖBL I. 2010b: Cerambycidae, Cerambycinae – Western Palaearctic taxa, eastward to Afghanistan, excluding Oman and Yemen and the countries of the former Soviet Union, pp. 143-207. In: LÖBL I., SMETANA A. (ed.): Catalogue of Palaearctic Coleoptera. Apollo Books. Stenstrup, 6: 924 pp.
SAMA G., LÖBL I. 2010c: Cerambycidae, Lamiinae – Western Palaearctic taxa, eastward to Afghanistan, excluding Oman and Yemen and the countries of the former Soviet Union, pp. 207-241, 264-334. In: LÖBL I., SMETANA A. (ed.): Catalogue of Palaearctic Coleoptera. Apollo Books. Stenstrup, 6: 924 pp.
SAMA G., BUSE J., ORBACH E., FRIEDMAN A.L.L., RITTNER O., CHIKATUNOV V. 2010: A new catalogue of the Cerambycidae (Coleoptera) of Israel with notes on their distribution and host plants. Munis Entomology & Zoology, 5 (1): 1-55.
SIMANDL J., 2002: New and Interesting Records of Beetles (Coleoptera) from Bulgaria. Acta Zoologica Bulgarica, 54 (2): 59-66.
SLÁMA M. 1997: On the taxonomy of taxa related to Grammoptera auricollis Mulsant & Rey (Coleoptera, Cerambycidae). Lambillionea, 4 (1): 512-514.
SLÁMA M., SLÁMOVÁ J. 1996: Contribution to the recognition of Greek and Yugoslavian Longicorn beetles (Coleoptera, Cerambycidae ). Biocosme Mésogéen, Nice, (1995), 12 (4): 117-143.
STEINER S. 1975: Eine neue Grammoptera-Art aus Grieschenland (Coleoptera, Cerambycidae). Zeitschrift der Arbeitgemeinschaft österreichischen Entomologen, 1974, 26 (1): 22-23.
TEUNISSEN A. 2002: Waarnemingen van Xylotrechus stebbingi in Griekenland: Een Aziatische wespenboktor die zich in korte tijd heeft verbreid in het Middellandse-Zeegebied (Coleoptera: Cerambycidae). Entomologische Berichten, Amsterdam, 62 (2): 57-58.
VITALI F. 2004: Xylotrechus smei (Castelnau & Gory, 1841): its presence in Western Palaearctic region and description of the pupa (Coleoptera, Cerambycidae). Doriana, 7 (340): 1-7.

